宜兴市人民医院国家药物临床试验机构于2019年10月顺利通过国家药品监督管理局的现场资格认定(证书编号1024),并于2020年通过国家药物临床试验机构备案现场监督检查(备案号:药临床机构备字2020000730)。2020年备案医疗器械临床试验机构(备案号:械临机构备202000119)。
一、临床试验机构信息
机构名称 | 宜兴市人民医院国家药物临床试验机构 |
机构电话 | 0510-83055564,83055565 |
机构邮箱 | gcp@yxph.com |
接待时间段 | 工作日:上午08:00~12:00;下午13:30~17:30 |
机构办公室地址 | 江苏省宜兴市新城路1588号,门诊综合楼四楼东南角 |
药物备案专业 | 呼吸、心血管、老年病(老年呼吸)、骨科、肿瘤、眼科、内分泌、急诊医学科、I期-BE |
医疗器械备案专业 | 呼吸科、眼科、心血管内科、骨科、老年科、医学检验科、医疗美容科、重症医学科、普外科、消化内科、医学影像科、烧伤科、内分泌科、肾内科、麻醉科 |
流程时长 | 前期调研沟通意向至同意承接一般时长:一周内 立项至启动会一般时长:两周左右 立项、伦理、合同审核能否同时进行:先立项,伦理和合同审核可同时进行 |
服务范围 | 药物临床试验:I期/BE、II期、III期、Ⅳ期 医疗器械临床试验:II类、III类 |
机构立项资料 | 1. 临床试验立项申请表(PI签字) 2. 药物临床试验批准通知书 3. 申办方营业执照 4. 药品生产许可证 5. 药品GMP证书 6. CRO公司资质证明 7. 药物检验合格证 8. 研究者手册(注明版本号、版本日期) 9. 试验方案(注明版本号、版本日期)(PI签字) 10. CRF表(注明版本号、版本日期) 11. 受试者日记卡(注明版本号、版本日期) 12. 知情同意书(注明版本号、版本日期) 13. 招募广告(注明版本号、版本日期) 14. 主要研究者资质证明(履历、执业资质、职称证书、GCP培训证书)(履历PI签字) 15. 临床试验委托书 16. 组长单位伦理委员会批件 17. CRA资质和委托书 18. 保险 19. 其他 |
二、伦理委员会信息
| |
| |
| |
| |
| 院外外网访问地址:https://eth.yxph.com:8899/,院内外网访问地址:https://172.16.168.142:8899/,医院职工用户名:staff工号,院外人员用户名:姓名+角色,如张三CRC或张三CRA,初始密码统一设置为Yxrm6005!,需要秘书授权后方可登录,登录以后修改为自己的密码,然后上传资料。 |
| 工作日:上午08:00~12:00;下午13:30~17:30 |
| 江苏省宜兴市新城路1588号,门诊综合楼四楼东南角 |
| 每月 28 号召开伦理审查会议,遇节假日顺延至下一个工作日(需要时可以增加临时的审查会议)。请在会议审查一周前提交送审文件。 |
| 临床试验初始审查常规为会议审查,临床试验联盟或者伦理审查协作联盟的内推项目,初始审查可快速审查。 |
| |
| 1. 临床试验伦理初始审查申请表(申请者签名并注明日期)8. 现有的安全性资料(如果其他文件里已包含则不用单独递交)10. 主要研究者专业履历及 GCP 培训证书复印件11. 组长单位伦理委员会批件、其他伦理委员会对申请研究项目的重要决定15.其他(本院为试验分中心的,其余资料应与组长单位递交文件清单一致) |
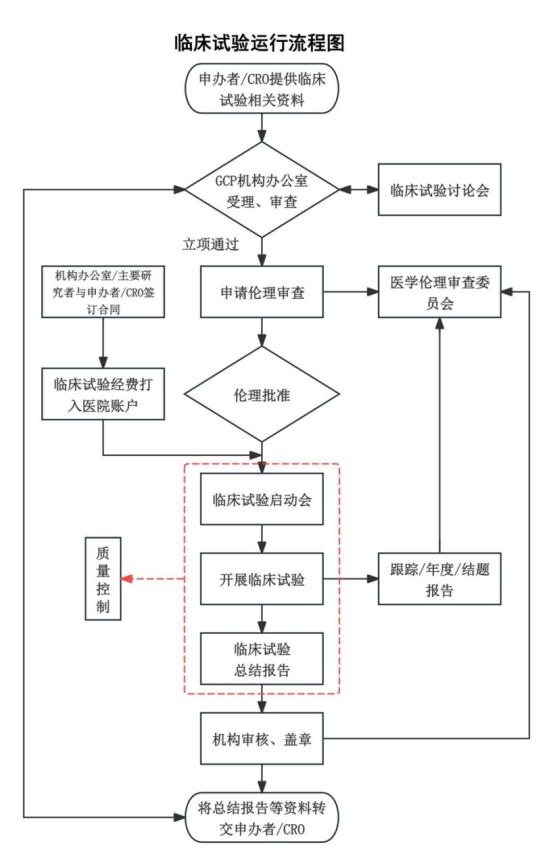
三、临床试验项目运行流程
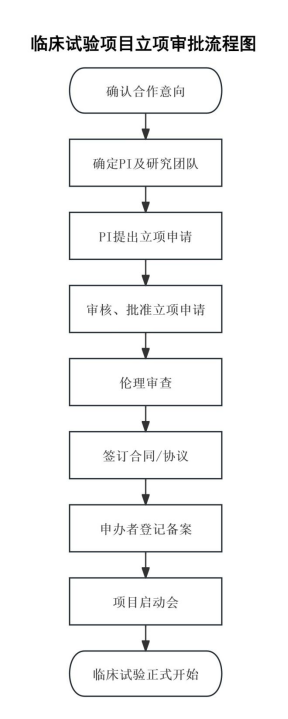
四、临床试验办事指南流程
1.临床试验项目立项审批流程
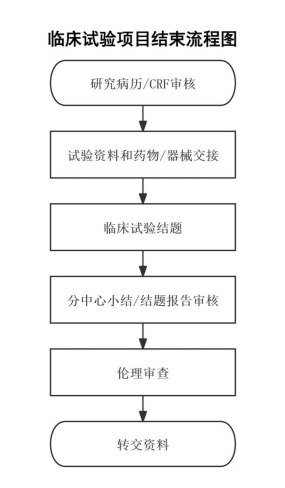
2.临床试验项目结束流程
3.临床试验经费汇款账户及发票开取流程(专票、普票都可以)
汇款信息
统一社会信用代码:12320282466455146Q
发票开取流程
临床试验经费转账后,请向机构办公室邮箱提交电子版银行转账凭证、联系方式及开票信息(注明需要专票或普票)。机构办公室收到邮件后将通知计财科核实临床试验费用到账情况,根据汇款单位及汇款明细开具正式财务发票。发票开出后,机构办通知申办者/CRO。